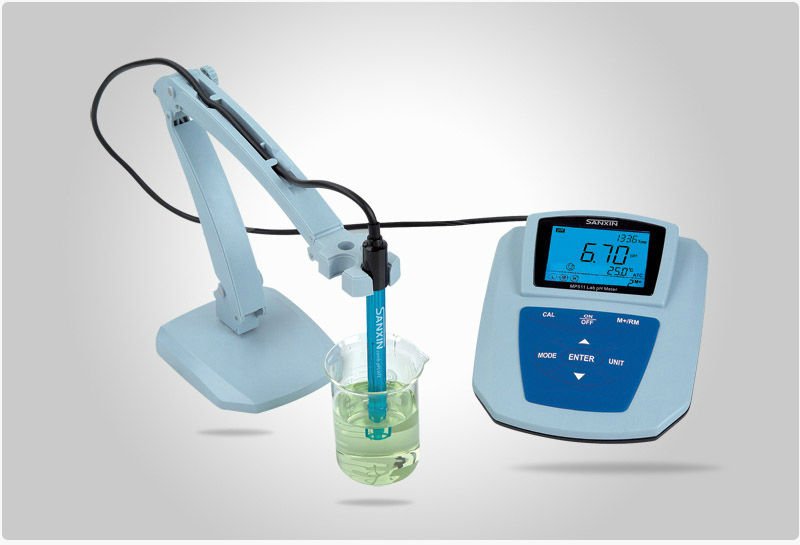
Potensiometri adalah suatu cara analisis berdasarkan pengukuran beda potensial sel dari suatu sel elektrokimia. Metode potensiometri digunakan untuk menentukan konsentrasi suatu ion (ion selective electrode), pH suatu larutan, dan menentukan titik akhir titrasi.
Alat-alat yang diperlukan dalam metode potensiometri adalah :
- Elektrode pembanding (refference electrode)
- Elektroda indikator (indicator electrode)
- Alat pengukur potensial
Elektroda Indikator terdiri dari :
Elektroda ion logam
- Paling umum digunakan adalah elektroda logam perak
- Respon baik untuk ion perak (Argentometri)
- Respon lain terhadap ion-ion yang membentuk senyawa perak yang sukar larut
Elektroda lembam (Inert)
- Biasanya menggunakan platina
- Digunakan untuk mengukur reaksi redoks
- Kurang baik untuk reduktor kuat
Elektroda selaput/ selektif ion
- Hanya peka pada salah satu ion saja
- Paling banyak digunakan adalah indikator gelas untuk pengukuran pH
- Kelemahan : muncul kesalahan alkali, kesalahan ini timbul karena elektroda gelas memberikan respon terhadap konsentrasi ion alkali dalam larutan yang bersifat basa.
Proses titrasi potensiometri dapat dilakukan dengan bantuan
elektroda indikator dan elektroda pembanding yang sesuai. Dengan demikian, kurva titrasi yang diperoleh dengan menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan, mempunyai kenaikan yang tajam di sekitar titik kesetaraan. Dari grafik itu dapat diperkirakan titik akhir titrasi. Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaraan sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indikator. Titik akhir dalam titrasi potensiometri dapat dideteksi dengan menetapkan volume bila mana terjadi perubahan potensial yang relatif besar ketika ditambahkan titran.
elektroda indikator dan elektroda pembanding yang sesuai. Dengan demikian, kurva titrasi yang diperoleh dengan menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan, mempunyai kenaikan yang tajam di sekitar titik kesetaraan. Dari grafik itu dapat diperkirakan titik akhir titrasi. Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaraan sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indikator. Titik akhir dalam titrasi potensiometri dapat dideteksi dengan menetapkan volume bila mana terjadi perubahan potensial yang relatif besar ketika ditambahkan titran.
Reaksi-reaksi yang berperan dalam pengukuran titrasi potensiometri yaitu reaksi pembentukan kompleks, reaksi netralisasi, pengendapan, dan reaksi redoks. Pada reaksi pembentukan kompleks dan pengendapan, endapan yang terbentuk akan membebaskan ion terhidrasi dari larutan. Umumnya digunakan elektroda Ag dan Hg, sehingga berbagai logam dapat dititrasi dengan EDTA. Reaksi netralisasi terjadi pada titrasi asam basa dapat diikuti dengan elektroda indikatornya elektroda gelas.
Potensial sel galvanik tergantung pada aktivitas zat-zat ionik tertentu di dalam larutan sel, maka pengukuran potensial sel merupakan hal yang sangat penting dalam kimia analitik. Dalam banyak hal suatu sel dapat disusun yang potensialnya tergantung pada aktivitas suatu macam zat ionik tunggal dalam larutan. Salah satu elektroda sel harus sedemikian rupa hingga potensialnya tergantung pada aktivitas ion yang akan ditentukan; ini disebutelektroda indikator. Elektroda yang lainnya merupakan sebuah pembanding, seperti kalomel, yang potensialnya diketahui dan tetap selama pengukuran (Underwood, 1986).
Proses titrasi potensiometri dapat dilakukan dengan bantuan elektroda indikator dan elektroda pembanding yang sesuai. Dengan demikian, kurva titrasi yang diperoleh dengan menggambarkan grafik potensial terhadap volume pentiter yang ditambahkan, mempunyai kenaikan yang tajam di sekitar titik kesetaraan. Dari grafik itu dapat diperkirakan titik akhir titrasi. Elektroda indikator adalah elektroda yang potensialnya bergantung pada konsentrasi ion yang akan ditetapkan dan dipilih berdasarkan jenis senyawa yang hendak ditentukan. Sedangkan elektroda pembanding adalah elektroda yang potensialnya diketahui dan selama pengukuran tetap konstan. Elektroda pembanding yang banyak digunakan adalah elektroda kalomel karena konstannya potensial yang dihasilkan. Antara elekroda pengukur (elektroda indikator) dan elektroda pembanding terdapat jembatan arus atau garam dengan larutan elektrolit yang di dalamnya terdapat transport ion arus. Cara potensiometri ini bermanfaat bila tidak ada indikator yang cocok untuk menentukan titik akhir titrasi, misalnya dalam hal larutan keruh atau bila daerah kesetaran sangat pendek dan tidak cocok untuk penetapan titik akhir titrasi dengan indikator.
Keuntungan dari metode potensiometri adalah biayanya yang relatif murah dan sederhana. Voltameter dan elektroda jauh lebih murah daripada instrumen saintifik yang paling modern. Selain itu kelebihan dari metode potensiometri yaitu pada saat potensial sel dibaca tidak ada arus yang mengalir dalam larutan (arus residual tatanan sel dan efek polarisasi dapat diabaikan). Manfaat potensiometri juga untuk menetapkan tetapan kesetimbangan. Potensial-potensial yang stabil sering diperoleh dengan cukup cepat dan tegangan yang mudah dicatat sebagai fungsi waktu, sehingga potensiometri kadang juga bermanfaat untuk pemantauan yang kontinyu dan tidak diawasi.
Potensiometri pada dasarnya bersifat nondestruktif terhadap sampel, dalam pengertian bahwa penyisipan elektroda tidak megubah komposisi larutan uji (kecuali untuk sedikit kebocoran elektrolit dari elektroda acuan) . Metode potensiometri merupakan salah satu metode yang banyak digunakan untuk menentukan kandungan ion-ion tertentu dalam suatu larutan, titrasi terhadap vitamin c (bersifat asam) mungkin juga bersifat basa. Selain itu, metode potensiometri dapat juga digunakan dalam penetapan nikel dan kobal dengan pengkomlekskan denga sianida, penetapan flourida dengan metode titik nol, penetapan besi (III) dengan EDTA dan standarisasi larutan kalium permanganate dengan kalium iodide.
Titik akhir dalam titrasi potensiometri dapat dideteksi dengan menetapkan volume pada mana terjadi perubahan potensial yang relatif besar ketika ditambahkan titran. Dalam titrasi secara manual, potensial diukur setelah penambahan titran secara berurutan, dan hasil pengamatan digambarkan pada suatu kertas grafik terhadap volum titran untuk diperoleh suatu kurva titrasi. Dalam banyak hal, suatu potensiometer sederhana dapat digunakan, namun jika tersangkut elektroda gelas, maka akan digunakan pH meter khusus. Karena pH meter ini telah menjadi demikian biasa, maka pH meter ini dipergunakan untuk semua jenis titrasi, bahkan apabila penggunaannya tidak diwajibkan.
Bermacam reaksi titrasi dapat diikuti dengan pengukuran potensiometri. Reaksinya harus meliputi penambahan atau pengurangan beberapa ion yang sesuai dengan jenis elektrodanya. Potensial diukur sesudah penambahan sejumlah kecil volume titran secara berturut-turut atau secara kontinyu dengan perangkat automatik.
Tidak ada komentar:
Posting Komentar